
-jsou nejlehčí ze všech známých kovů vůbec,mají tendenci lehko přecházet v kladně jednomocné ionty,směrem od Li k Cs rostou jejich kovové vlastnosti a s tím se zvětšuje i jejich hustota (první tři jsou lehčí než voda ),ale naopak klesá jejich teplota varu a tání.Při obyčejné teplotě se dají krájet nožem. Na vzduchu se rychle oxidují a v důsledku vlhkosti přecházejí na zásady,proto se uchovávají většinou pod petrolejem nebo jinými indiferentními uhlovodíky. V suchém kyslíku shoří na svoje peroxidy kromě Li ,které hoří na oxid lítný pouze s příměsí svého peroxidu,vodou se peroxidy hydrolyzují a vzniká tak peroxid vodíku a příslušný hydroxid.Oxidy alkalických kovů se připravují nepřímo tavením peroxidů s přebytkem daného kovu.Tyto kovy reagují s vodou za vývoje vodíku. Hydroxidy jsou většinou bílé na vzduchu silně vlhnoucí a slučují se s oxidem uhličitým na uhličitany.Kromě vody se rozpouštějí i v jiných polárních rozpouštědlech, ve kterých jsou zpravidla plně disociovány,a proto patří mezi silné zásady.Stupeň zásaditosti roste také spolu s kovovými vlastnostmi.Alkalické soli silných kyselin reagují v roztocích neutrálně,soli slabších kyselin reagují zásaditě.Většina jejich solí je dobře rozpustná ve vodě,pouze malý počet solí prvních tří alkálií je ve vodě, buď málo rozpustné nebo vůbec nerozpustné.Rozpustnost stoupá spolu s teplotou kromě toho, že u chloridu sodného téměř stagnuje.S dvojsytnými kyselinami dávají nejdříve kyselé a až po zahřátí normální soli,jsou dobře rozpustné ve vodě pouze ortofosforečnan lítný se rozpouští jen málo.Jejich kationty jsou bezbarvé a soli buď bílé nebo také bezbarvé,pokud barevnost nezpůsobuje aniont.Soli (především chloridy) barví také plamen Li - tmavočerveně , Na - žlutě , K,Rb a Cs - fialově,toho se využívá při analytickém důkazu.

-je to stříbrolesklý kov,celkově je nejlehčím kovem ,plave na vodě i lihu.Na vzduchu se pokrývá vrstvičkou nitridu lítného,zušlechťují se s ním hořčíkové slitiny a jeho páry se používají při žíhání a kalení kovů k odstranění posledních zbytků nepříznivých plynů a par.Používá se také na výrobu léků.Stopy
lítných solí v popelu cigaret působí jako katalyzátor,cukr prosypaný popelem cigaret se dá zapálit.Hydrid lítný se používá jako pevná zásoba vodíku.Přísada hydroxidu lítného v akumulátorech zvyšuje jejich elektrickou kapacitu.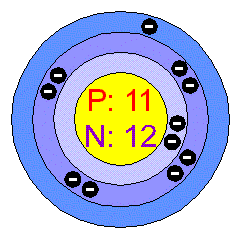
-sodík je biogenní prvek ,který se získává především z NaCl ,je důležitý pro tvorbu červených krvinek v organizmech a v žaludku je obsažen v podobě HCl Jeho výroba spočívá v elektrolýze roztoku NaCl. Je stříbrolesklý kov s modravým nádechem měkký jako vosk a vyznačuje se také velkou reaktivností. Používá se na vysoušení kapalin a transformátorových olejů,používá se také jako chladící činidlo do leteckých motorů a jaderných reaktorů.Používá se též jako přísada do neonových lamp.
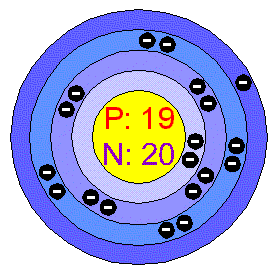
-je to tzv.prvek úrodnosti,patří mezi 10 nejhojnějších prvků na Zemi.Vyrábí se elektrolýzou hydroxidu draselného,je to měkký kov,který se dá krájet nožem. Na vzduchu se pokrývá vrstvičkou oxidu draselného a dostává jakýsi modravý nádech,proto se stejně jako většina alkálií uchovává nejčastěji
pod petrolejem. Jeho slitina se sodíkem se uplatňuje při syntéze organických sloučenin např. gumy.Teprve tento prvek je typickým představitelem 1.A-skupiny alkalických kovů.-je to jeden z prvků objevených spektrální analýzou,na jeho objevení pracovalo hned několik vědců najednou mezi nimi i Mendělejev a náš vědec B.Brauner, avšak bylo objeveno Kirchhoffem a Bunsenem.Kovové Rubidium se nejlépe připraví působením hořčíku na hydroxid rubidný v proudu vodíku,je vzácný kov , měkčí než vosk.Je reak
tivnější než draslík a na vzduchu i ve vodě se samovolně zapaluje,musí se proto uchovávat např. pod parafínovým olejem a je dokonce šestkrát lehčí než zlato.Je zajímavé tím,že působením světla se z něj stává zdroj elektrické energie.Jeho halogenidy se dají použít v medicíně jako utišující prostředky.-je kovem technické revoluce,byl objeven Bunsenem a Kirchhoffem v r. 1860,je to velmi vzácný kov :Jeho výroba spočívá v redukci uhličitanu césného hořčíkem ve vakuu.Tento kov je stříbrolesklé namodralé barvy,nejměkčí a nejreaktivnější ze všech kovů,proto se uchovává v parafínovém oleji.Zajímavé je,že se taví i při teplotě dlaně,při styku s vodou se vznítí a vzniká jeden z nejsilnějších hydroxidů - hydroxid césný CsOH.Cesium také vyzařuje elektrony při
ozáření. Cesium umožnilo sestrojit tzv.introskop,kterým je vidět i přes neprůhledné látky (dřevo,kov a i dokonce vnitřek organizmu ).