Prvky B.skupin
Cu-měď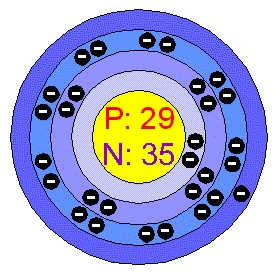
-dostala svůj název podle ostrova Kypru-kde se prvně tavila,v přírodě se vyskytuje buď jako ryzí kov nebo častěji ve sloučeninách.Je to také prvek biogenní, který urychluje vnitrobuněčné procesy.Je to červený kov,kujný a tažný.Je jedním z nejlepších a nej
používanějších vodičů elektrického proudu.Teto kov je však jedovatý,a proto se z něj vyrobené nádoby ještě pocínovávají.Plechy z mědi se používají na pokrytí střech kvůli tomu,že se nemusejí natírat a to,protože se pokrývají v důsledku působení oxidu uhličitého slabou vrstvičkou uhličitanu mědnatého-zvaného také měděnka.Jeho nejznámější sloučeniny jsou se Zn-mosaz,s Sn-bronz, s Ni a Zn-nové stříbro atd.
Ag-stříbro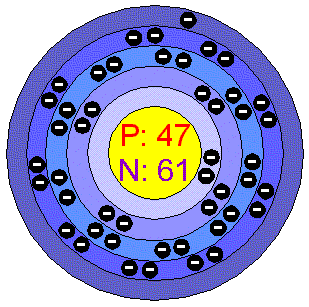
-jeho název je odvozen od slova v překladu znamenajícího" jasný".Dříve se používalo na výrobu mincí a společně se zlatem tvořilo sloučeninu nazývající se"asem", které se nejvíce používalo v Malé Asii.Je zajímavé že se v ranném středověku jeho cena blížila ceně zlata.Stříbro se v přírodě nachází buď v
čisté formě nebo ve formě sloučenin,nejčastěji jako sulfid stříbrný-argenit atd.Stříbro je ušlechtilý,bílý,tažný a kujný kov je vůbec nejlepším vodičem elektrického proudu.Pokud na tento kov působíme sirovodíkem stříbro černá v důsledku vzniku sulfidu stříbrného,tato černota se dá odstranit vyvařením v sodě.Solí stříbra se využívá při důkazu halogenidů,kromě fluoridu.
Au-zlato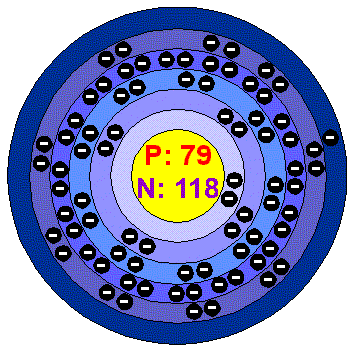
-dostalo název podle" ranní záře-Aurory",je to jeden z nejdražších kovů vůbec.Asi jedna třetina zlata - cca 50 000 tun-je jako mezinárodní měnový kov uzavřena v podzemních trezorech světových bank.Odhaduje se, že v zemské kůře je asi 0,005 g zlata na 1 tunu horniny.Nalézané kousky zlata mohou mít rozměry téměř neviditelné až ohromující ja
ko např. hrouda vážící 32 kg nalezená na Uralu nebo 112 kg kusu zlata nalezeného na Klondaiku. Zlato se nachází buď čisté ne v různých sulfidech jako olovnatých,stříbrných,také v teluridech atd.Dříve se zlato získávalo plavením,to se však později nahradilo tzv.amalgací-to znamená ,že se horniny obsahující zlato smísí se rtutí,která rozpustí zlato na amalgán,poté se destilací od sebe obě složky oddělí.Horniny chudší na zlato se dají vyluhovat také v kyanidu sodném nebo chlorové vodě- znečišťují vodní toky jedy.Zlato se dá těžit i z mořské vody,která má obsah asi 5,5 tun zlata na km3. Tento kov je na vzduchu stálý,lesklý lehce nažloutlí, nejkujnější ze všech kovů vůbec.Hodnota zlaté slitiny se udává v karátech.Pokud chceme oddělit zlato od stříbra můžeme to udělat tzv.kvartací-rozpuštěním stříbrné složky v kyselině dusičné.Analyticky se zlato stanovuje vytavením s olovem.
Zn-zinek
-tento kov je již známí více než 3000 let.Jeho název je odvozen od německého slova -zink-(zubatý,rohatý),kvůli rudě kalamínu uhličitému,ze které se původně získával. Zinek se nejvíce vyskytuje v horninách jako je sfalerit,smitsonit-uhličitan zinečnatý,hemimorfit-hydrát tetraoxokřemičitanu zinečnatého atd.Zinek se získává pražením rud na oxid zinečnatý,který se poté redukuje uhelným p
rachem,dá se také vyrobit elektrolyticky s použitím hliníkové katody a anody z olova.Zinek je modrobílý kov,krystalický a lesklý,ale také křehký.Na vzduchu se pokrývá vrstvičkou svého oxidu,proto slouží jako ochranný povlak na předmětech.Pozinkování se zprostředkovává mnoha způsoby např.elektrolyticky ,postříkáním,sherardováním-zahřátím ocelového plechu v práškovém zinku,ponořením do kys.sírové poté do taveniny (ZnCl2 + HN4Cl) a ponořením do roztaveného zinku s malým množstvím hliníku.Jeho sloučeniny jsou všechny jedovaté.
Cd-kadmium
-kadmium se vyskytuje celkem hojně v zinkových horninách.Jeho objevení spočívalo v náhodě,když farmaceutická firma Hermann musela dokázat,že v jejím léku není obsažen jedovatý arzen-objev se připisuje F.Stromeyerovi.Tento kov je stříbrobílý a měkký,dokonce více než zinek,ale je také velmi tažné a kujné.Slouží také jako ochranná tenká vrstva.V jaderných reaktorech se používají kadmiové tyče jako regulátory toku neutronů.Všechny jeho sloučeniny jedovaté.
Hg-rtuť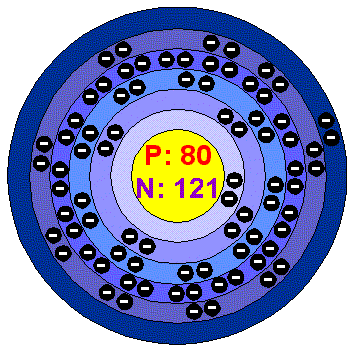
-její název je odvozen od řeckých slov v překladu znamenajících "tekuté stříbro".Je známá již asi 2400 let.Rtuť je jediný kov,který je při obyčejné teplotě kapalný.Volně se vyskytuje rozptýlená v kapičkách v horninách popř.nerostech jako rumělka nebo cinabarit-sulfid rtuťnatý.Jinak je to stříbrolesklá prchavá kapalina,jejíž páry jsou jedovaté. Rtutí se pro její tepelnou roztažnost plní kapiláry v teploměrech.Rtuťové lampy vyzařují ultrafialové světlo používané v horských sluncích
,uplatnění nachází i při těžbě zlata a stříbra amalgací.Amalgací cínu a kadmia se zhotovují zubní plomby.Třaskavá rtuť (fulminát rtuťnatý) tvoří bílé krystalky,které třením nebo nárazem snadno vybuchují,proto se používají na výrobu zapalovačů výbušnin a bouchacích kuliček.
Sc-skandium
-je to světlešedý lesklý kov,tavící se nad teplotu 1500 stupňů,připravuje se elektrolýzou chloridu skanditého.
Y-ytrium
-jeho sloučeniny se analogicky podobají sloučeninám hliníku,jeho oxidy a hydroxidy jsou nerozpustné v alkalických hydroxidech.Jeho halogenidy jsou nerozpustné ve vodě.
La-lantan
-název má od řeckého slova "skrývám se",protože ho chemici dlouho nemohli poznat,vyrábí se z něho křesací kamínky do zapalovačů,protože je pyroforický.Lantan se připravuje elektrolýzou chloridu lantanitého.Je to těžký namodralý kov,na vzduchu se pokrývá svým oxidem.Jeho slitina s hořčíkem se používá v leteckých motorech.
Ti-titan
-je pokládán za kov budoucnosti objevil ho W.Gregor,je pojmenován podle mýtických Titánů,patří k deseti nejrozšířenějším prvkům na zemi.Vyrábí se redukcí železných rud hliníkem jako ferotitan s obsahem 10-15% titanu,je to lehký ocelověšedý kov.je kovatelný a tažný,je možné ho dobře válcovat i na tenké fólie,je velice odolný proti korozi, proto se používá ve
strojírenství-používají se především jeho slitiny s vanadem a hliníkem.Slitiny s hořčíkem a hliníkem odolávají teplotě až do 600 stupňům na krátký čas i 800 stupňů, titan odolává i nízkým teplotám.Používá se na ochranné pancíře i v astronautice.Nejpozoruhodnější je slitina titanu s niklem-tzv.nitinol-je lehká,pevná,ale především má dosud nevysvětlenou schopnost po deformaci a zahřátí vrátit se do svého původního stavu.
Zr-zirkonium
-je to kov používaný v reaktorech,název dostal od svého nerostu zirkonu,kterého odrůdou je hyacintom,pomocí kterého falšovali diamanty.Čisté zirkonium se připravuje rozkladem oxidu jodidu zirkoničitého na žhavém wolframovém vlákně.Je to ocelověšedý kov,u kterého jeho pásky stejně jako u hořčíku je možné zapálit.Pro jeho všestrann
ou odolnost se používá v raketových a leteckých motorech ale i jinde.
Hf-hafnium
-je stálým průvodcem zirkonia a velmi těžko se od něho odděluje,Na jejich oddělení se používá buď frakční krystalizace nebo rozdílná prchavost jejich halových sloučenin. Čisté se připravuje jako zirkonium,jinak je to velmi lesklý kujný kov,velice podobný zirkoniu.
V-vanad
-všechny jeho sloučeniny jsou jedovaté,podávané v malých dávkách zvyšují chuť k jídlu.Získává se redukcí fluoridu vanadičného sodíkem.Je to lesklý velmi tvrdý kov, ale je křehký.Používá se na výrobu pér do aut nebo vlaků atd.,odolává korozi i proti mořské vodě.Celkově je to prvek na výrobu dopravní techniky.
Nb-niob
-má vlastnosti podobné tantalu,v přírodě je velice vzácný.Připravuje se elektrolýzou fluoroniobičnanu nebo redukcí fluoridu niobičného kovovým sodíkem,je na vzduchu stálý. Využívá se i na výrobu žárovek i v klenotnictví se jím nahrazuje bílé zlato.Zvyšuje svým přídavkem tvrdost oceli.
Ta-tantal
-v přírodě provází většinou cínové a tantalové rudy.Je to tvrdý,pružný,těžký a kujný kov.Společně s chrómem poskytuje velice odolnou slitinu,která se používá v technice,ale i na výrobu chirurgických nástrojů.Je důležitý pro medicínu,protože nedráždí tkáň,používá se proto na opravu kostí.Je také odolný proti k
yselinám.
Cr-chrom
-jeho název pochází od slova "barva",je stříbrolesklý kov,křehký ale velice tvrdý (proto se muže použít na rytí do skla )-Řadí se kvůli své vrstvě oxidu na povrchu ke kovům, které jsou odolné proti korozi.Avšak přímé chromování železa není možné,protože se jeho vrstva odlupuje,proto je nutné nejdříve železné předměty poniklovat nebo pomědit. Přidáním chrómu získávají ostatní kovy větší tvrdost.Dokonce již 0,5g oxidu chromitého (chromová zeleň ) usmrcuje člověka.
Mo-molybden
- až 90% molybdenu na světě je vázáno v molybdenitu MoS
2.Je to stříbrobílý a těžkotavitelný kov,proto je vhodné ho používat na výrobu odporů elektrických pecí a nosičů wolframových vláken v žárovkách.Má tak vysokou tvrdost,že umožňuje opracovávání ocelí,skla,žuly atd.,používá se i jako katalyzátor při zpracování ropy.
W-wolfram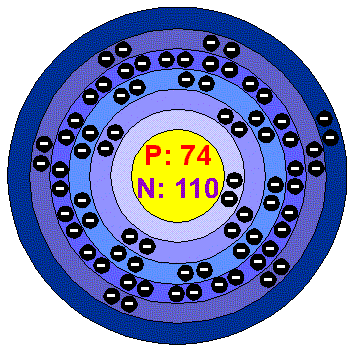
-je to žáruvzdorný kov.Získává se redukcí oxidu wolframového vodíkem nebo rozkladem chloridu wolframového na rozžhaveném wolframovém vlákně.Wolfram je černý prášek,který má ze všech známých kovů nejvyšší tepotu tání (3410
oC ),proto se zpracovává tzv.práškovou metalurgií-to znamená,že se hydraulickým lisem při tlaku 330 kPa vylisuje na požadovaný tvar a poté se zahřeje elektrickým proudem na 2500oC,zrníčka wolframu na povrchu změknou,nalepí se na sebe a spečou se. A po dalším mechanickém zpracování se získá bílý kov,který tažný,proto z něho jdou vyrobit tenká žárovková vlákna.Jeho přísada v oceli zvyšuje její tvrdost a odolnost proti opotřebení (výroba např.pilníků ).
Mn-mangan
-vyskytuje se buď ve vlastních ložiskách nebo společně s železnými rudami,řadí se také mezi biogenní prvky.Vyrábí se aluminotermicky z manganových rud obsahujících železo, ale nezískává se čistý,obsahuje totiž asi 20-70% železa-a je to tzv. feromangan.Mangan je šedý kov,který na vzduchu mění barvy a je velice křehký.Mangan se používá k dezoxidaci ocele,odstraňuje také fosfor,síru a jiné plyny.Manganová ocel je velice pevná a houževnatá.Avšak řada jeho sloučenin je mnohem důlež
itější než je on sám.
Tc-technecium
-tento prvek byl připraven uměle v r.1937,je to radioaktivní prvek s poločasem rozpadu 2.10
5 let.Získává se z jaderného odpadu.Při nízkých teplotách je to supervodivý kov.
Re-rhenium
-je to těžký,tažný a kujný kov a podobá se platině.Odolává i korozi,je výborným katalyzátorem.Jeho slitiny s drahými kovy zvyšují jejich tvrdost.Jeho výroba je však velice nákladná.
Fe-železo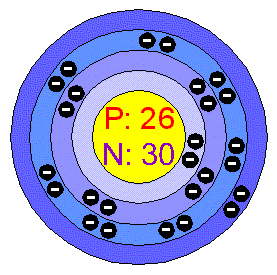
-je to čtvrtý nejrozšířenější prvek na zemi.Předpokládá se,že spolu s niklem tvoří zemské jádro.Tvoří také značnou část meteoritů,které spadnou na Zem.
Ru-ruthenium
-svou barvou a leskem se podobá platině a je také velice tvrdé a křehké.Je však špatně rozpustné v lučavce královské.Využívá s v mnoha slitinách např.platina s 10% ruthenia se používá na výrobu kontaktů pro letecké motory,chirurgické pomůcky a zapalovač plynů.
Os-osmium
-je vzácný kov,který provází platinu.Má nepříjemný zápach,páry jeho oxidu dráždí oči a dlouhodobé působení může mít za následek oslepnutí.Je to modrobílý kov,velmi tvrdý, ale také křehký.Je těžší než železo i olovo,je vlastně nejtěžším kovem na zemi.Vyznačuje se svou vysokou teplotou tání,proto se může používat jako vlákno do žárovek.
Co-kobalt
-v přírodě se nachází vždy společně s niklem a arzénem, nejčastěji v nerostech jako je smaltin (Co, Ni )As
2 a kobaltin (Co,Ni )AsS-tyto rudy se poté redukují uhlíkem na kov.Kobalt je tmavší než nikl a také nepodléhá korozi (pokovování nožů ).Je také důležitou součástí magnetických ocelí.Jeho slitina "kovar"je vhodná na spájení skla s kovem a je také odolná proti párám rtuti.Ozářením kobaltu vzniká tzv.radiokobalt, který se používá na ozařování rakovinných nádorů a na chyb v kovových tělesech. CoCl2.6H2O na papíře je jeho růžový roztok neviditelný a po zahřátí nad plamenem ( odpaření vody ) vynikne jeho modrá barva.Sloučeninami kobaltu se také může sklo barvit na modro.
Rh-rhodium
-je lesklý,velmi tažný a kujný kov,z platinových kovů je nejdražší.Nerozpouští se ani v lučavce královské.Má větší lesk dokonce i než stříbro a jeho výhoda spočívá v tom, že působením vodíku nečerná.
Ir-iridium
-je to kov, který je velice tvrdý.Je z něho možno zhotovovat odpory v lab.pecích,které se dají používat bez ochranné atmosféry až do 1700 stupňů celsia.Přidává se ostatním platinovým kovům na zvýšení jejich tvrdosti.Např. prototyp metru uloženého v Paříži je z 90% Pt a 10% Ir ( z této slitiny je zhotoven i mezinárodní kilogram ).
Ni-nikl
-v němčině znamená "darebák", jeho výroba spočívá v tom, že se vypraží sulfidové rudy na oxid nikelnatý a ten se potom dále redukuje uhlíkem až na nikl.Čistý se podle Monda získává rozkladem karbonylu niklu Ni (CO)
4 jako až 99,99% nikl.Je to bílý, lesklý, kujný a tažný kov na vzduchu stálý,slabě feromagnetický.Tvoří se z něho opět potahy předmětů před korozí.Jemně rozptýlený nikl (Raney-nikl )se jako katalyzátor dá použít při ztužování tuků hydrogenizací, protože pohlcuje vodík.
Pd-palladium
-nejvíce se vyskytuje společně s platinou,zlatem a stříbrem.Je to nelacinější a zároveň nejlehčí platinový kov,již není tak odolné proti kyselinám jako ostatní platinové kovy.Je velice dobře tvárné.Tento kov celkem značně pohlcuje vodík.Používá se jako katalyzátor při syntézách organických látek např.vitamínů a hormonů, ale také na redukci př
i hydrogenizaci.PdCl2 se využívá a zjištění CO ve vzduchu, protože i jeho drobné stopy dokáží vyloučit kovové palladium.Lesk tohoto kovu opět převyšuje lesk stříbra.
Pt-platina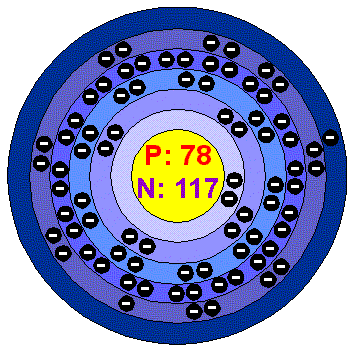
-ještě před jejím poznáním si ji lidé pletli se stříbrem.V přírodě se může vyskytovat buď ryzí nebo společně s ostatními platinovými kovy.Platinu i ostatní platinové kovy jde od sebe jen velice těžko oddělit.Po vyvaření v lučavce královské zůstává pouze osmium a iridium nerozpuštěné os
tatní přecházejí do roztoku.Jinak je platina stříbrolesklý kov se šedivým nádechem.Slitina s iridiem (viz.iridium) tvoří materiál pro mezinárodní kilogram i metr.Používá se i jako častý katalyzátor.Platina patří mezi ušlechtilé kovy.






