-s rostoucí atomovou hmotností od Be k Ba stoupá i jejich schopnost vytvářet kladně dvojmocné ionty, zesiluje se také jejich kovový charakter a stoupá zásaditost, rozpustnost a stálost hydroxidů.Poslední čtyři prvky ve skupině se již silně podobají alkalickým kovům, a proto se nazývají kovy alkalických zemin.Ale oproti alkal.kovům mají o dost vyšší teploty tání,nejvyšší teplotu tání má berylium,které má i nejvyšší tvrdost.Všechny se ochotně slučují s halovými prvky a při vyšších teplotách i s dusíkem za vzniku nitridů,i s uhlíkem na karbidy a s vodíkem na hydridy atd.Na vzduchu se pokrývají vrstvičkou svých oxidů.Všechny reagují s vodou za vzniku vodíku.Hydroxid berylnatý a hořečnatý jsou ve vodě nerozpustné,proto se reakce u Be téměř okamžitě zastavuje a u hořčíku probíhá velmi neochotně u dalších prvků jsou reakce již dosti bouřlivé.Hydroxidy berylnatý a hořečnatý vznikají také reakcí příslušných solí s hydroxidy alkal.kovů.Ve vodě jsou dobře rozpustné jejich dusičnany a halogenidy ,rozpustnost síranů a uhličitanů klesá v řadě od Be k Ba. Jejich uhličitany se ve vodě rozpouštějí jen nepatrně a jsou při zvýšené teplotě méně stálé než u alkal.kovů (nejstálejší je uhličitan barnatý ).Kyselé uhličitany poznáme v roztocích jejich převařením,přičemž přecházejí v normální uhličitany. Jejich soli zbarvují charakteristicky plamen a to tak,že vápník červeně,stroncium karmínově a barium žlutozeleně.

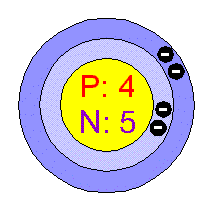
-jeho první příprava se uskutečnila až roku 1828 ,když se dvěma nezávisle pracujícím chemikům podařilo ho získat z oxidu berylnatého redukcí draslíkem,ale v současnosti se připravuje elektrolýzou fluoridu berylnatého.Celkově je berylium lesklý,nekorodující kov lehčí než hliník.Tento prvek i jeho sloučeniny jsou jedovaté.Používá se často do slit
in (např. beryliový bronz ,který se svou tvrdostí a houževnatostí vyrovná nejkvalitnější nemagnetické oceli a používá se na výrobu strun a pérek do hodinek ). Také přídavek 2-3% tohoto prvku v mědi zvýší její tvrdost až pětkrát.Slitiny ze 6 - 7% berylia jsou tvrdé jako ocel.Zajímavé je,že při úderu do berylia neodlétají jiskry. Používá se také v jaderných reaktorech a pří odstřelování částicemi alfa vyzařuje tzv.neutronové záření.Užívá se u něj označení"strategického kovu".-je to důležitý biogenní prvek při tvorbě listové zeleně - chlorofylu.Hořčík se vyrábí z páleného magnezitu nebo dolomitu.Je to stříbrolesklý lehký kov, na vzduchu se opět pokrývá vrstvičkou svého oxidu,která ho chrání před korozí.Jeho plíšek hoří oslnivým plamenem, nesmí se hasit
vodou, protože se při tom uvolňuje výbušný plyn-vodík. Hořčík je lehčí než hliník asi o 40%,proto mají jeho slitiny široké použití.Jeho slitiny s některými kovy se používají pro jejich lehkost i na výrobu letadel a jiných strojů,tyto slitiny se opracovávají stejně dobře jako dřevo.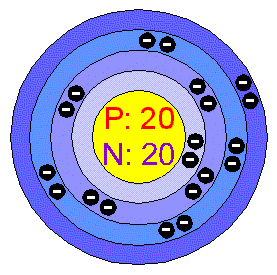
-je to jeden z biogenních prvků,v lidském těle je vázán na kosti ve formě uhličitanů a fosforečnanů.Jeho nejznámější sloučenina se nazývá vápenec.Vápník se získává elektrolýzou taveného roztoku chloridu vápenatého,poprvé ho takto získal H.Davy v r. 1808.Je to stříbrolesklý bílý kov,který je třetím nejvíce se vyskytujícím kovem.Jeho sloučeniny se používají ve stavebnictví,v cukrovarnictví, na impregnaci dřeva a tkanin pro snížení jejich hořlavosti atd.Spolu s hořčíkem způsob
uje tvrdost vody.Má silné elektropozitivní charakter a vyskytuje se ve formě bezbarvých dvoumocných kationů.Barví plamen do červena.Zapálený v atmosféře kyslíku vzniká jeho kysličník,zahříváním v proudu dusíku vytváří svůj nitrid a ve vodíku hybrid.S vodou reaguje pozvolna za vzniku hydroxidu a vodíku.Zajímavé je, že se stoupající teplotou rozpustnost CaO (páleného vápna) ve vodě klesá.V přírodě existuje bílý síran vápenatý jako anhydrit ve vodě málo rozpustný.Ale přesto z vodného roztoku krystalizuje při zvýšené teplotě jako dihydrát,který se zahříváním mění na hemihydrát,který se používá jako obyčejná sádra.-je to kov červených ohňů,získává se z oxidu strontnatého,je to měkký kov,který se samovolně zapaluje tmavočerveným plamenem,proto se uchovává ponořený většinou do toluenu.Zajímavost je, že tento kov byl původně dražší než zlato.Z jeho sloučenin je nejznámější dusičnan strontnatý,který zabarvuje bengálské ohně a signální rakety.
-tento prvek objevil opět Davy v r.1774,barium se vyrábí redukcí oxidu barnatého ferosiliciem ve vakuové peci nebo elektrolýzou roztoku chloridu barnatého na rtuťové katodě.Barium je stříbrolesklí měkký kov,velmi reaktivní,proto se uchovává ponořeno do petroleje.Využívá se i v průmyslu např.se s ním někdy nahra
zuje antimon ve tvrdém olovu na výrobu střel.Jeho sloučeniny jsou jedovaté a barví plamen na zeleno.Tento kov pohlcuje i radioaktivní záření.BaS s obsahem alkálií a se stopami manganu nebo bismutu dává světélkující směs,která se používá v hodinářství atd.Dusičnan barnatý zabarvuje jiskry ohňostrojů na zeleno.