Laboratorní práce
Cíl práce:
Potvrzení závislosti vodivosti roztoku NaCl na koncentraci NaCl a na teplotě
Úkol: 1) Zjistit vliv
a) koncentrace NaCl na
vodivost roztoku NaCl
b) teploty na vodivost
roztoku NaCl
2) Stanovit koncentraci neznámých roztoků NaCl
zadaných vyučujícím
Princip: Ionty
Na+, které jsou přítomny v roztoku NaCl, umožňují průchod střídavého
elektrického proudu tímto roztokem (snižují odpor R roztoku). Hodnota 1/R
je opakem odporu a při určitém zjednodušení se označuje jako jeho vodivost.
Přípravou sady roztoků o stoupající koncentraci NaCl a proměřením jejich
vodivosti lze zjistit vliv koncentrace na vodivost roztoku NaCl (podklady pro
vznik grafu č.1). Změřením vodivosti roztoků NaCl při různých teplotách lze
potvrdit vliv teploty na vodivost.
Proměřením
neznámých vzorků obdržených od vyučujícího a odečtením naměřených hodnot
vodivosti proti hodnotám koncentrace z grafu č.1 (kalibrační křivky) se lze
vyrovnat s úkolem č. 2 této laborat. práce.
Vlastní měření
lze realizovat dvojím způsobem. Při prvním se použije konduktometr, tj.
přístroj určený k měření vodivosti roztoků. Není-li k dispozici konduktometr,
jako je tomu v tomto případě, lze úkol splnit měřením proudu procházejícího
roztokem, pomocí mA metru (viz oddíl Postup). Naměřené hodnoty proudu se podle
Ohmova zákona (I = U/R) na vodivost přepočítají. Jednotkou vodivosti je
Siemens.
Pomůcky: mA
metr, spojovací dráty, vodivostní čidlo, 25 ml odměrné baňky, 25 ml kádinky,
temperovatelná vodní lázeň, 10 ml dělená pipeta , odměrná baňka na 100 ml,
rychlováhy, střička s destilovanou (redestilovanou) vodou
Chemikálie a roztoky: pevný NaCl, p.a.
Postup: Postup si několikrát
C E L Ý !! přečti a osvoj si jej
tak, abys měl (a) vždy přehled o tom, v
které fázi pokusu se nalézáš a jaký krok bude následovat
V rámci
domácí přípravy vypočítej, kolik gramů NaCl navážíš, abys po jeho rozpuštění v
100 ml odměrné baňce na získal 1% roztok. Po kontrole výpočtu vyučujícím roztok
připrav. Obsah baňky pak přelij do lahve označené zásobní roztok NaCl.
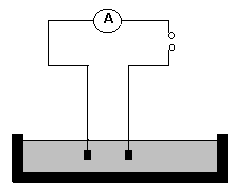 Ad 1a) vliv koncentrace:
(sestrojení kalibrační křivky (grafu č. 1)). Ze zásobního roztoku do
očíslovaných 25 ml odměrných baněk odpipetuj pomocí dělené 10 ml pipety 1, 2,
3, 4, 5 , 7,5 a 10 ml NaCl. Baňky doplň po značku destilovanou vodou, zazátkuj
a několikerým překlopením obsah promíchej. Do 25 ml kádinky vlij obsah baňky
č.1 a ponoř do ní vodivostní čidlo, spojené s mA metrem podle schéma na obrázku
vedle. mA metr smíš zapnout až po kontrole zapojení vyučujícím !! Na displeji
odečti s přesností na 1 desetinné místo proud, který protéká roztokem a
naměřenou hodnotu v mA zapiš do tabulky č. 1, jejíž formu si sám zvolíš. Čidlo
vytáhni, opláchni destilovanou vodou, osuš papírem a ponoř do kádinky č. 2, do
níž jsi před tím nalil roztok z baňky č. 2. Naměřenou hodnotu odečti a zapiš.
Analogickým způsobem proměř zbývající
roztoky. Zjištěné hodnoty použiješ k
přepočtu proudu na vodivost. Za hodnotu U dosaď do Ohmova zákona napětí
o velikosti U=6,3 V. Vodivost vyjádři v hodnotách milisiemens (mS).
Ad 1a) vliv koncentrace:
(sestrojení kalibrační křivky (grafu č. 1)). Ze zásobního roztoku do
očíslovaných 25 ml odměrných baněk odpipetuj pomocí dělené 10 ml pipety 1, 2,
3, 4, 5 , 7,5 a 10 ml NaCl. Baňky doplň po značku destilovanou vodou, zazátkuj
a několikerým překlopením obsah promíchej. Do 25 ml kádinky vlij obsah baňky
č.1 a ponoř do ní vodivostní čidlo, spojené s mA metrem podle schéma na obrázku
vedle. mA metr smíš zapnout až po kontrole zapojení vyučujícím !! Na displeji
odečti s přesností na 1 desetinné místo proud, který protéká roztokem a
naměřenou hodnotu v mA zapiš do tabulky č. 1, jejíž formu si sám zvolíš. Čidlo
vytáhni, opláchni destilovanou vodou, osuš papírem a ponoř do kádinky č. 2, do
níž jsi před tím nalil roztok z baňky č. 2. Naměřenou hodnotu odečti a zapiš.
Analogickým způsobem proměř zbývající
roztoky. Zjištěné hodnoty použiješ k
přepočtu proudu na vodivost. Za hodnotu U dosaď do Ohmova zákona napětí
o velikosti U=6,3 V. Vodivost vyjádři v hodnotách milisiemens (mS).
Ad 1b) vliv teploty: Obsah kádinek č. 1-7 vytemperuj na
vodní lázni na 40o C a tak jako v bodě ad 1a) proveď měření proudu
protékajícího roztokem. Zapisuj do tabulky č.2. Přepočet hodnot naměřeného
proudu na vodivost proveď analogicky jako v bodě ad 1a).
Ad 2) stanovení koncentrace NaCl: Odměrné baňky s
roztokem NaCl, které obdržíš od vyučujícího a v nichž máš zjistit koncentraci
NaCl, doplň po značku destilovanou vodou, zazátkuj, promíchej a postupem jako
shora, změř proud protékající přísl. roztokem a přepočti na vodivost. I tato
měření prováděj na 1 desetinné místo. Postupem popsaným níže pak v rámci
zpracování protokolu zjistíš koncentraci NaCl obdržených roztoků.
Výsledky a závěry:
1) Pomocí
tabulkového kalkulátoru (např. Excel (příp. jiný)) vytiskni na tiskárně na
samostatný list papíru rozměrově co největší bodový graf typu Y/X, tj.
závislost vodivosti roztoku v mS na zvyšující se koncentraci NaCl v
mililitrech. Současně s touto závislostí vytiskni i její spojnici trendu, tj.
regresní křivku. Do grafu vytiskni i regresní rovnici. Závislost
představuje graf č.1 (tzv. kalibrační křivku)
2) Na základě
zjištěné závislosti v grafu č. 1 se písemně
vyjádři o vlivu koncentrace na vodivost roztoku NaCl
3) Z regresní
křivky, tj. grafu č. 1 u vzorků od
vyučujícího odečti koncentrace roztoků NaCl v ml a uveď do protokolu: Vzorek č. 1 obsahoval ….ml NaCl, vzorek č. 2
obsahoval ….. ml NaCl, vzorek č. …. atd. Pokud jsi matematicky na výši,
vypočítej koncentraci neznámých vzorků v mg, příp. v molech či milimolech
4) Dosazením
experimentálně zjištěných hodnot
neznámých vzorků za hodnoty y
do regresní rovnice ( v podstatě
rovnice přímky typu Y = kX + q (viz analytická geometrie)), vypočítej koncentraci (hodnoty x ) neznámých vzorků. Tyto vypočtené
hodnoty srovnej s hodnotami, které jsi uvedl do závěru do bodu 3). Napiš, které výsledky jsou přesnější a
proč
5) Pomocí téhož
kalkulátoru vytiskni společný bodový graf závislosti vodivosti na
koncentraci roztoků NaCl při laboratorní teplotě (podle postupu ad 1a) a při 40o
C (podle postupu ad 2) (graf č. 2)). Písemně se vyjádři o vlivu teploty na
vodivost roztoku a své závěry zdůvodni.
6) Obě tabulky
a oba grafy přilož k protokolu
7) Do protokolu
napiš, proč se při konduktometrii vkládá na elektrody střídavý a ne
stejnosměrný elektrický proud
![]() Poznámka:
Poznámka:
1.
Uvědom si, že hlavním
(a klasifikovatelným) výstupem z této lab. práce je splnění úkolu ad 2).
Plněním úkolu ad 1) sestrojuješ kalibrační křivku potřebnou pro zjištění
koncentrace NaCl v neznámém vzorku
2.
V rámci přípravy
do cvičení se m.j. bezpodmínečně
seznam s problematikou konduktometrie na Související stránce 5 !
3.
Nemáš-li možnost
grafy vytisknout na počítači, k jejich konstrukci použij milimetrový papír (nutno zakoupit v obchodě
s papírnickými potřebami) !
4.
Uvědom si, že
i banální chyba na konci cvičení může mít za následek, že budeš muset úlohu
opakovat v náhradním termínu !!
Související
stránka 1
Související
stránka 2
Související
stránka 3
Související
stránka 4
Související
stránka 5
Související
stránka 6
Poslední úprava : 29.12.2005