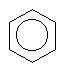
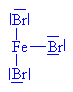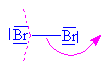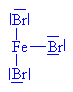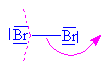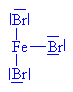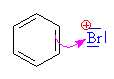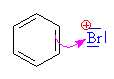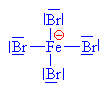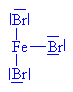Schématický
zápis
|
|
|
Podrobný
zápis
|
| Bromid železitý je Lewisova kyselina a
přijímá tudíž bromidový anion |
|
|
| |
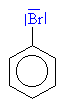
| Vzniká bromný
kation , který je elektrofilním činidlem |
|
|
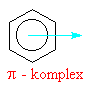
| Bromný kation
se napojuje na aromatický systém benzenu přes tzv. p komlex. Zjednodušeně a
názorněji (i když poněkud nepřesně) se dá říci,
že na jednu z dvojných vazeb (konjugovaného 6 -ti
elektronového systému) se napojuje elektrofilní
činidlo |
|
|
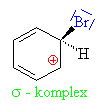
| Aromatické jádro přestalo existovat, na sousedním
uhlíku od napadeného je kladný náboj (má pouze 3
vazby - 2 s uhlíky a jednu s vodíkem)- vznikl tzv. s komlex , je velká snaha obnovit
stabilní aromatické jádro: |
|
|
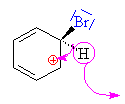
| Při obnování stabilního aromatického jádra se
odpojuje vodíkový kation a jím uvolněná vazba se
zapojuje do jádra a tak opětně vzniká stabilní
aromatický 6 elektronový kruh. Vznikl brombenzen |
|
|
| Odštěpený vodíkový kation se napojuje na tetrabromidový anion
a za vzniku bromovodíku
a bromidu železitého
(ten tedy slouží jako katalyzátor) se rozbíhá
další kolo reakce |
|
|