 |
+ |
|
|
|
|
|
|
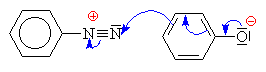 |
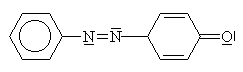 |
 |
|
|
 |
|
|
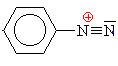
| Ke kopulaci dochází u diazoniových solí zásluhou velké elektronové hustoty na 4, příp. 2 uhlíku druhé složky reakce. Diazoniová sůl je slabé elektrofilní činidlo a proto je třeba hustotu na příslušném uhlíku patřičně zvýšit . Reakce je Se (elektrofilní substituce). Druhou komponentu tvoří většinou aminosloučenina ( viz.methyloranž, methylčerveň, kongočerveň) a nebo fenol. | ||||||||||||||||||||||||
| Kopulace fenolů - schématický zápis | ||||||||||||||||||||||||
|
||||||||||||||||||||||||
| Kopulace - podrobný zápis | ||||||||||||||||||||||||
| Pro rekci je třeba zásadité prostředí, aby se z fenolu stal fenolát, který způsobuje podstatně vyšší + M efekt | ||||||||||||||||||||||||
|
||||||||||||||||||||||||
| Zásluhou +M efektu způsobeného volnými elektronovými páry na kyslíku fenolátu dochází k velkému zvýšení elektronové hustoty v polohách 2 a 4. Ze sférických důvodů v poloze 4 (v poloze 2 pak, pokud je poloha 4 obsazena) se chová dusík z diazoniové skupiny jako elektrofilní činidlo a napojuje se. Dochází tak v jedné části arénu k dočasnému porušení aromatického charakteru | ||||||||||||||||||||||||
|
||||||||||||||||||||||||
| Protože je aromatické jádro velmi stabilním útvarem, dochází k jeho obnovení. Z tohoto důvodu se odpojuje vodíkový kationt na prvním uhlíku | ||||||||||||||||||||||||
|
||||||||||||||||||||||||
| Anion přijímá vodíkový kation | ||||||||||||||||||||||||
|
| Diazotace a kopulace ( výroba methyloranže, výroba methylčerveně, výroba kongačerveně ) |
nahoru , reakční mechanismy , dusíkaté sloučeniny , organická chemie ,go home