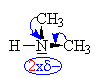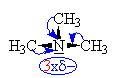| Lze
odhadnout pH aminosloučenin v porovnání
navzájem a s vodou???Odpověď zní
- ano zásluhou působících efektů. Pamatuj tuto
zásadu: sloučenina se "snaží"
mít co nejmenší náboj. Pokud má vzniknout ion (ať
už kation nebo anion) "ochotněji" vznikne
tam, kde je náboj kompenzován částěčným nábojem
opačného znaménka, neboli tam, kde je náboj v
absolutní hodnotě menší než jedna. Nejhůře pak
tam, kde naopak je náboj větší v absolutní hodnotě
než jedna. |
| Je známo, že kyselina odštěpuje
vodíkové kationty a důsledku toho má pH menší než 7. Zásada naopak
vodíkové kationty přijímá a v důsledku toho má pH větší než 7. |
| |
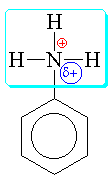
aromatický
amin (př.:anilin)
 |
|
anilinium
 |
|
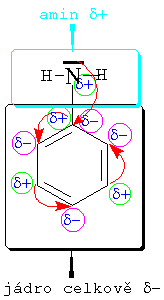
U aromatického
aminu (např.: anilinu) působí +M
efekt, který způsobuje
volný elektronový pár na dusíku. Ten se
snaží zapojit do konjugace na jádru a snižuje
tak elektronovou hustotu na dusíku (vzniká
částečně kladný náboj).Při přijetí
vodíkového kationtu a vzniku anilinia (tzn. projevu zásady) tento částečně
kladný náboj oddaluje celkový náboj na
dusíku od nuly /1+d/ > /1/. Z toho
plyne, že částečně kladný náboj zhoršuje
podmínky pro přijímání vodíkového
kationtu, takže anilin je méně
zásaditý než amoniak i když je (vzhledem k
dále uvedené rovnici) zásaditější
než voda a pH má větší než 7).
| zásada |
<-- |
----------- |
------------> |
konjugovaná
kyselina |
|
|
| C6H5NH2 |
+ |
H2O |
 |
C6H5NH3+ |
+ |
OH- |
| anilin |
|
kyselina |
<------------ |
----------------- |
--> |
konjugovaná
zásada |
|
|
|
|
|
|
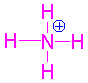
| U amoniaku nepůsobí
žádný efekt.Při přijetí
vodíkového kationtu a vzniku amonného
kationtu neboli amonia
(tzn. projevu zásady) vzniká
náboj +1.Z toho plyne, že amoniak je
zásaditější než anilin a pH má větší. |
|
|
|
|
|
| U primárního
aminu
(př.:methylamin) působí
alkylová skupina +I
efektem,
který
způsobuje zvýšení elektronové
hustoty na dusíku, na kterém tak
vzniká částečně záporný náboj.
Při přijetí vodíkového kationtu a
vzniku methylamonia
(tzn. projevu zásady) tento
částečně záporný náboj
přibližuje celkový náboj na dusíku k
nule /1-d/ </1/. Z toho
plyne, že
částečně záporný náboj podporuje
přijímání vodíkového kationtu,
takže primární
amin je
zásaditější než amoniak a pH má větší. |
|
|
|
|
|
|
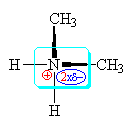
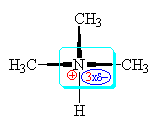
| U terciárního
aminu
(př.:trimethylamin) působí 3 alkylové
skupiny 3x +I
efektem,
ty způsobují
zvýšení elektronové hustotyna dusík,
na kterém tak vzniká částečně
záporný náboj.. Při přijetí
vodíkového kationtu a vzniku trimethylamonia
(tzn. projevu zásady) tento
částečně záporný náboj
přibližuje celkový náboj na dusíku
více k nule /1-3xd/ </1-2xd/ než sekundárního
amin. Z toho
by mělo
plynout, že terciární
amin je
zásaditější než sekundárního
amin a pH má větší, ale
není tomu tak(!!), 3 alkylové skupiny
natolik stíní dusíku
(sférický moment),
že snižují jeho schopnost přijímat
vodíkový kation(tzn. projev zásady)
, že je terciární
amin
méně zásaditý i než primární
amin! |
|
|
Pořadí aminů dle vzrůstající zásaditosti je:
voda(pH=7)
< aromatický
< amoniak<
terciární
< primární<
sekundární
|
| Pokračuj dále v
podrobnějším členění: deriváty
anilinu
a vliv různých alkylů |
| Pozn.: pH bylo
seřazeno za předpokladu stejné koncentrace. Závislost
pH u aminosloučenin jako
slabých bází na koncentraci (v případě silného
aniontu) se rovná: pH = 7
- 1/2(pKB + log cBH+). Bližší zde |
| Porovnej s
vlivem efektů na pH u hydroxiderivátů |