| Schématický zápis: |
|
|
| Podrobný zápis: |
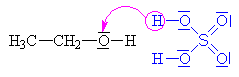
| Kyselina sírová se chová jako kyselina a ethanol
jako zásada, to
znamená že volný elektronový pár na kyslíku v
ethanolu přijímá vodík a vzniká ethyloxoniový
kationt (kyslík má pouze 5 elektronů a proto má
náboj plus). Chybějící elektron získává
heterolytickým odštěpením od uhlíku.Odštěpovaná
voda je nahrazována mechanismem nukleofilní substituce
Sn (porovnej s halogenderiváty).
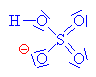
Nukleofilním činidlem je hydrogensulfát (zde je
použit mechanismus molekulární Sn1, mechanismus Sn2 ukázán dole nebo zde klikni). |
 |
 |
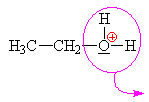
ethyloxoniumhydrogensulfát
 |
 |
|
| |
|
|
 |
| |
-H2O |
|
|
|
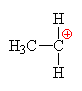
| Vzniklý karbokation se spojuje s
hydrogensulfátovým aniontem za vzniku anorganického
esteru ethanolu a kyseliny sírové. |
| |
|
|
 |
| |
-H2O |
|
|
 |
|
 |
 |
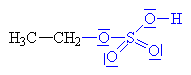
| ethylhydrogensulfát
(kys.
ethylsírová) |
 |
|
|
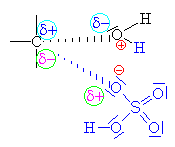
| Ester se může rozpadnout dále na ethylen a
hydrogensíran (klikni) |
| Zde obecně
znázorněna substituce bimolekulovým
mechanismem Sn2
|
 |
|



